面对新型冠状病毒疫情,戴口罩,不仅是对自己的保护,更是对大家的保护。所以口罩一时间成为热销产品更是必备用品!医用防护口罩是指可过滤空气中的微粒,阻隔飞沫、血液、体液、分泌物等的自吸过滤式防尘医用防护口罩。今天润扬仪器根据网络上相关资讯整理和大家分享一下,医用口罩的生产过程。
根据国家局《医用口罩产品注册技术审查指导原则》,以产品的预期用途和适用范围为依据,一般分为:
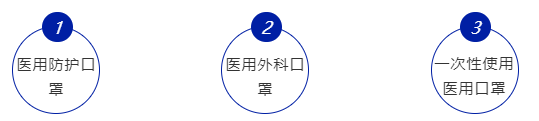
医用外科口罩适用于医务人员或相关人员的基本防护,以及在有创操作过程中阻止血液、体液和喷溅物传播的防护。医用外科口罩应符合YY 0469-2011《医用外科口罩》。
一次性使用医用口罩适用于佩戴者在不存在体液和喷溅风险的普通医疗环境下的卫生护理。一次性使用医用口罩应符合YY/T 0969-2013《一次性使用医用口罩》要求。
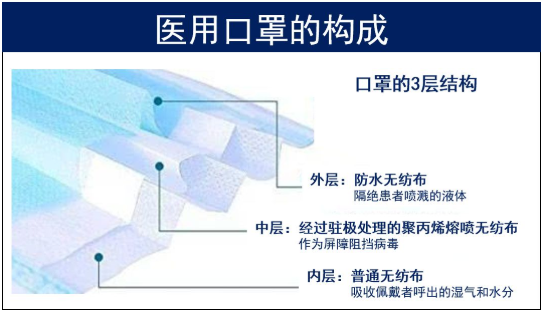
常见的医用口罩主要由三层无纺布组成:内层是普通无纺布,外层是做了防水处理的无纺布,中间的过滤层是经过驻极处理的聚丙烯熔喷无纺布。
医用口罩的主要原料便是无纺布。无纺布的质量直接关乎于口罩的质量和消费者的安全。在无纺布生产中,其表面容易受到金属碎屑等异物的污染。通过的异物自动检测设备,能够自动地检测异物,很好地控制无纺布的产品质量,有效节省人工检测环节的人力成本,提升检测和生产速度,满足大规模生产的要求。
以下我们润扬将介绍口罩生产的几个重要的环节。
医用口罩的生产环境及要求
医用口罩的生产需要无尘无菌的环境,车间要达到10万级净化车间的要求。还要求应有空调净化系统、纯化水系统。口罩从原料进厂,需经过口罩成型、压合、切边、呼吸阀焊接(如有)、耳带点焊、鼻梁条线贴合、呼吸阀冲孔(如有)、包装、EO灭菌、解析(EO灭菌)、检测等多个工艺环节方可制造完成。
为实现以上制造过程,需配置全自动生产设备或半自动生产设备。全自动设备是一体成型,一般1台本体机拖2到3台耳带机,从原料投料到包装完成都可实现。而半自动设备则需按以上流程逐个配置,包括口罩成型机、口罩压合机、口罩切边机、呼吸阀冲孔机、鼻梁条线贴合机、耳带点焊机、呼吸阀焊接机等。
医用口罩的灭菌
对于生产的医用无菌口罩,必须通过灭菌工序方可放行。对于跨界进行入口罩行业,这无疑是个门槛。灭菌可以通过委托灭菌,也可以购买灭菌设备自行灭菌。市面上一般由环氧乙烷(EO)灭菌和辐照灭菌两种方式。考虑到辐照灭菌剂量控制不好会对熔喷布带来影响导致过滤效率不符合要求,所以绝大部分企业都选用EO灭菌。由于EO灭菌使用的是有毒有害的环氧乙烷,所以灭菌后还需进行解析,分为自然解析和灭菌柜解析。一般而言,自然解析的周期约为14天,才能确保口罩中残留的环氧乙烷达标。
医用口罩的检测要求
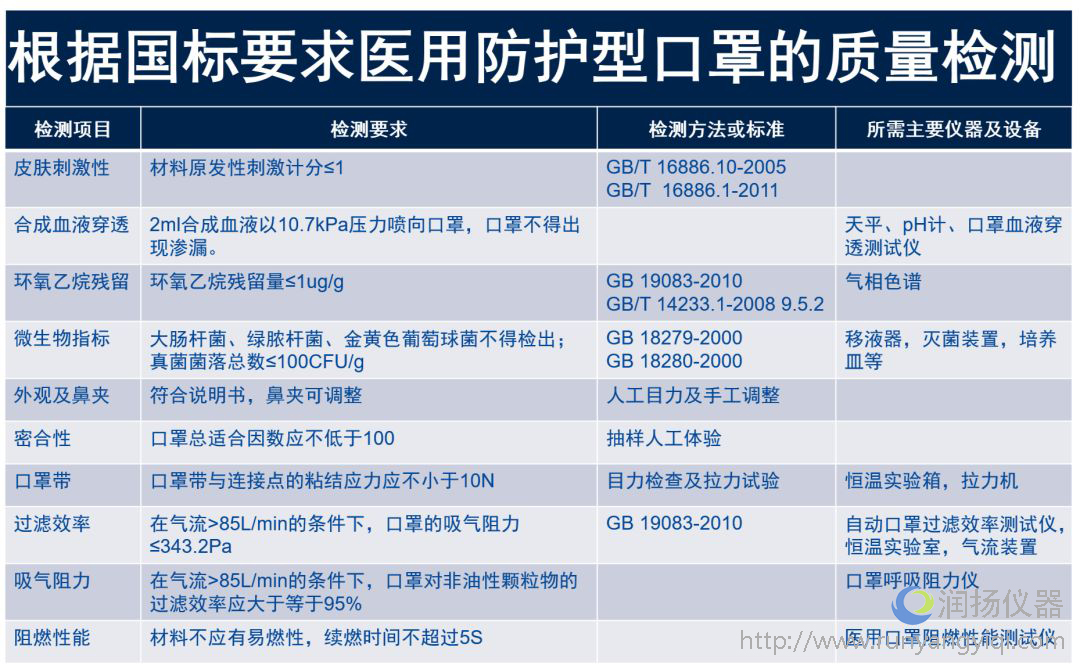
医用口罩产品的检测包括两部分:出厂检验和型式检验。
(1)出厂检验项目至少应有以下项目:外观、结构与尺寸、鼻夹、口罩带、微生物指标、环氧乙烷残留量(若采用环氧乙烷灭菌)的要求。
(2)型式检验应为产品标准的全性能检验。
(3)检测蕞严格便是医用防护性口罩,具体详见下图:
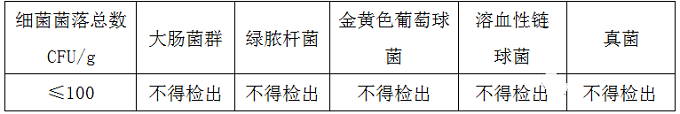
(4)关于微生物指标,灭菌口罩经环氧乙烷灭菌,应无菌,气相色谱仪检测其环氧乙烷的残留量应不超过 10μg/g。微生物指标、环氧乙烷残留检测这两项为每一批次出厂必检。对于非灭菌口罩(普通级)应符合下表的要求。口罩微生物指标
从疫情爆发以来,大多有资质的生产企业开始24小时加班加点满负荷生产,大量的“救命”口罩源源不断地从生产车间奔赴抗疫前线。由于数量大,批次多,为了不漏发任何一只口罩,企业在中转和包装发放环节面临如何快速准确地确认产品数量以避免缺件的难题。人工计数速度慢且经常出现差错,即便招募了大量志愿者帮助清点,计数环节仍然成为整个生产流程的瓶颈。某企业的做法值得推荐,他们选用了工业计数秤的方法,日产能由近20万只提升至30万只左右。
医用口罩其他相关问题
1、鉴于目前对医用口罩的过滤材料质量难以通过便捷有效的检验方式来控制,生产质量管理体系的规范运行是企业保证口罩产品质量稳定的主要手段,故在注册技术审评和体系考核中审核员和检查员会关注过滤材料的生产工艺及供货来源。
企业应对产品的过滤材料进行控制,明确过滤材料的来源及质量要求,具有相对稳定的生产工艺及供货来源以保证产品的质量。
2、医用口罩是二类医疗器械,理应走注册程序。在疫情条件下,部分省份可以进行备案管理,如广东省明确对于在一级响应期间新增拟开展医用口罩、防护服等属于二类防控器械产品注册和生产的,凭工信部门意见向所在地市药监局申请备案,市局在备案凭证中应注明“本备案仅在公共卫生事件一级响应期间适用”。
备案后,按以下方法放行:按照《中国药典》(2015年版)第三部1101无菌检测法开展无菌检验,在培养七天后未发现有微生物生长,其他理化指标均检测合格,可先放行。产品标签上应按照正常无菌检测完成时间标注使用的起始时间。企业在无菌检验后续培养观察时间内,发现不符合要求的,应及时召回。
3、医用口罩的安全性、有效性只是其起到防护作用的一部分因素。口罩正确的使用及佩戴方法也直接影响了防护的效果。因此在说明书中应明示出使用者需要的全部信息以避免口罩的误用,降低交叉感染的风险。
如注明佩戴方法、明确标识口罩正反面识别方法、使用时间的建议、注明滤料级别或相关说明等。另外,医护人员对于不同种类医用口罩的适用范围还没有十分明确的认识,应在说明书中清楚地注明口罩的适用范围并加强医护人员的培训工作。
4、无菌医用口罩在10万级洁净厂房条件下生产,其特点是尘粒蕞大允许数大或等于0.5微米的粒子数不得超过3500000个,大于或等于5微米的粒子数不得超过20000个。另外,微生物蕞大允许数,浮游菌数不得超过500个每立方米;沉降菌数不得超过10个每培养皿。
同时相同洁净度等级的洁净室压差保持一致,对于不同洁净等级的相邻洁净室之间压差要≥5Pa,洁净室与非洁净室之间要≥10Pa。这主要是为了保障空气从洁净区流向非洁净区,避免气流倒灌。温度一般控制在冬季20——22℃;夏季24——26℃;波动±2℃。冬季洁净室湿度控制在30-50%,夏季洁净室湿度控制在50-70%。对温度、湿度无特殊要求时,以穿着洁净工作服不产生舒服感为宜。其功能布置、设备设施和管理要求可参考《医疗器械洁净室(区)检查要点指南》。
润扬仪器一直在密切关注此次疫情的发展,也随时准备为此次疫情贡献一份力量。我们将提供绿色通道,为各大口罩生产厂商优先安排相关生产检测仪器设备及售后服务。武汉加油!中国加油!我们有信心、有能力一定能打赢这场新冠病毒疫情防御战!