资料统计,已知化合物中约80%的化合物是亲水性强、挥发性低的有机物,热不稳定化合物及生物大分子,这些化合物的分析蕞适合于液相色谱,当然毛细管电泳也可以,只不过毛细管电泳的毛细管中无填料,因此“变数”较少,适应的复杂体系也较少,远不及液相色谱使用得广泛。当和质谱联用时,液相色谱的流动相适合于流入质谱,LC-MS成为该类化合物质谱联用分析的主流;毛细管电泳的流动相中常加入缓冲盐,对于质谱不太友好,此外还需考虑毛细管出口端维持电泳的电流通路同时又可以进行电喷雾,由于“变数”少,接口较困难,因此CE-MS一直没有LC-MS应用得广泛。
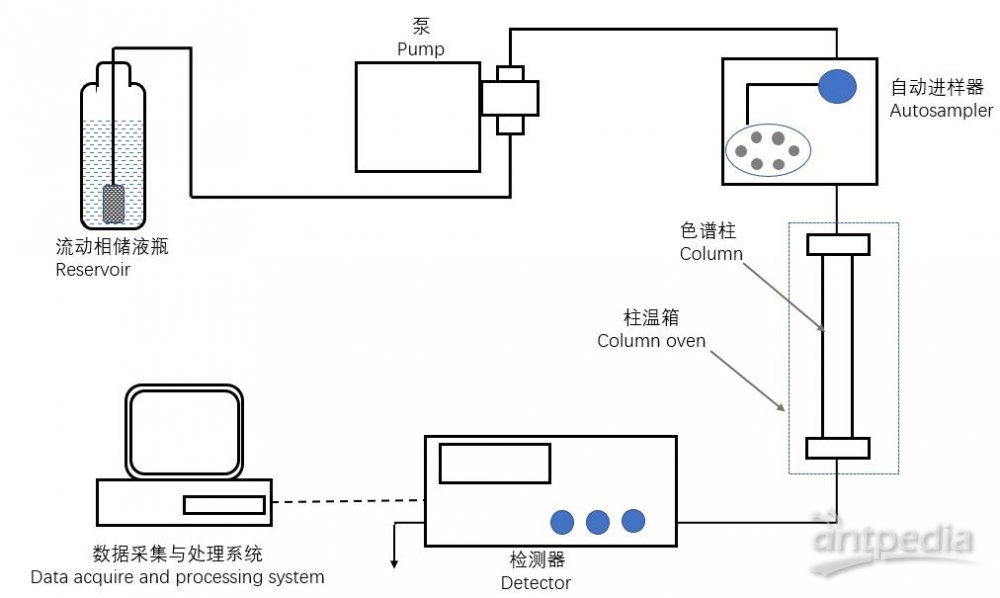
液相色谱的构造分为5大部分:进样部分(手动进样或自动进样),驱动液体流动的色谱泵,主导分离的色谱柱(有些配柱温箱),检测器、数据采集和分析系统。当同质谱联用时,质谱成为液相色谱的检测器,而为了同步数据采集及分析,色谱厂商通常开放接口,让质谱厂商的软件来控制液相色谱的进样和分离,数据分析也交给质谱厂商。
液相色谱结构图
在LC-MS联用时,通常在色谱柱前端加装短的保护柱来延长色谱柱寿命。若固定相使用未经修饰的氧化硅颗粒或修饰其它高极性物质,如氨基或氰基,则成为正相色谱,适合分析极性较强的分析物,洗脱时可通过调配极性差异大的两种流动相溶液(如水和乙腈)比例,而得到适当极性的单一流动相溶液进行等度洗脱。在复杂样品中,若要获得更佳的分离度,可以使用极性差异大的两种流动相溶液(如水和乙腈)进行梯度洗脱。若固定相为经过C18、C8或苯基柱,则称为反相色谱,适合分析低极性的化合物,亦可以进行等度或梯度洗脱。
在分析级液相色谱-质谱联用中,大都使用内径2.1mm或1mm的色谱柱,其流动相流速分别为约200~300 µL/min和50~75µL/min,有些情况下可使用4.6mm的色谱柱,其流动相流速为1mL/min,这时一般会在进入质谱前进行分流,让少部分进入质谱,而大部分分流后可进行回收。
超高效液相色谱分离时,固定相颗粒从5µm降至3µm与1.7µm以下,这时分离效率更高,但同时需要超高压液相泵(>400 bar或>6000psi),这时分离时间缩短到数分钟内且不损失分离效能。在超高效液相色谱-质谱联用时,其色谱峰底宽约在数秒内,因此在质谱方法设定上,需适当调整扫描速度以获得足够质谱图数,从而完整描绘色谱峰。
纳升级流速LC-MS常用于蛋白质组学等复杂微量样品的分析。降低柱内径可以得到较低的死体积,同时柱效大幅提高。例如,若原本用2.1mm的色谱柱分析样品,当转换至使用内径75µm毛细管柱且注入相同样品浓度时,理论上样品峰浓度将会增加至约784倍。因此使用毛细管色谱柱对于电喷雾质谱仪(浓度灵敏检测器)的信号提升将非常显著。此时,达到较佳理论塔板数的Zui佳流速约为255 nL/min,理想进样体积约24nL,这时需要更细微的注射器,不易实现。目前普遍的做法是,利用柱前端在线预浓缩方式,将微升级的样品体积浓缩在色谱柱的zui前端以缩小样品体积。另一方面,由于样品承载量减少,超载的样品量容易造成柱分离效率降低。为解决此问题,可在色谱分离柱的前端加入一个捕集柱(Trap Column),捕集柱的功能包含了样品预浓缩与去除过多的样品量。为匹配纳升级流速,一般需要纳升电喷雾接口。商品化的纳升级流速LC-MS构建上,常使用一个六通阀连接捕集柱与分离柱,在捕集柱进行预浓缩时同时去除大部分样品中的盐类,浓缩后洗脱样品到分离柱进行样品分离。